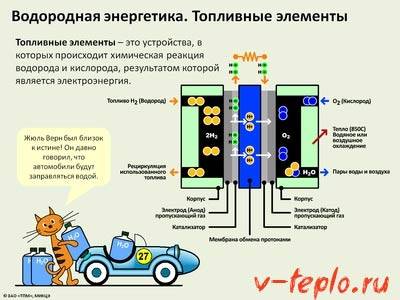
Синтез аммиака
Содержание:
- Технологическая схема — производство — аммиак
- Инструкция по применению
- Применение и использование
- Физические и химические свойства аммиака
- Применение нашатырного спирта в быту
- Научные принципы химического производства
- Химическое загрязнение окружающей среды и его последствия
- Создание интегрированных производств и разработка новых технологий имеют особое значение
- Применение и использование аммиака:
- Аммиак, формула, газ, характеристики:
- Производство серной кислоты
- Внедрение технологий для получения аммиака
Технологическая схема — производство — аммиак
Технологические схемы производства аммиака включают от 5 до 9 основных технологических блоков, таких, как очистка исходного сырья, производство азотоводородной смеси, синтез аммиака и другие.
Если технологическая схема производства аммиака включает промывку газа жидким азотом, целесообразно проводить высокотемпературную конверсию природного газа под давлением до 30 am при температуре около 1350 С. В этом случае сухой конвертированный газ содержит примерно 96 % ( СО Н2) при остаточной концентрации метана около 1 % и низких расходных коэффициентах по природному газу и кислороду.
Если технологическая схема производства аммиака включает промывку газа жидким азотом, высокотемпературную конверсию природного газа целесообразно проводить под давлением до 3 0 МПа при температуре окрло-1350 С. В этом случае сухой конвертированный газ содержит примерно 95 5 % ( СО Н2) при остаточной концентрации метана около 1 % и низких расходных коэффициентах по природному газу и кислороду.
Если в технологической схеме производства аммиака не предусмотрена промывка жидким азотом, но имеется медноаммиачная очистка, для высокотемпературной конверсии природного газа целесообразно применять воздух, обогащенный кислородом. При этом остаточная концентрация метана в конвертированном газе не должна превышать примерно 0 5 %; достижение этого связано с повышением температуры реакции до 1400 С.
Если в технологической схеме производства аммиака не предусмотрена промывка газа жидким азотом, но имеются отделения низкотемпературной конверсии оксида углерода и метанирования, для высокотемпературной конверсии природного газа целесообразно применять воздух, обогащенный кис -: лородом. При этом остаточная концентрация метана в конвертированном газе не должна превышать примерно 0 5 %, что связано с повышением тем-1 пературы реакции до 1400 С.
В зависимости от технологической схемы производства аммиака масло, растворенное и диспергированное в сжатом газе, по-разному влияет на следующие стадии производства аммиака. Если на заводе имеется медно-аммяачная очистка под тем же давлением, что и синтез, газовый поток, содержащий масло, попадает в первую очередь в скрубберы медно-вшшшч-ной очистки, где оно загрязняет раствор, ухудтгает условия очистки газа и регенерации медно-аммиачного раствора, увеличивает расходные коэффициенты. Имеются данные, что очистка газа от масла только на стадии медно-аммиачной очистки дает.
В зависимости от технологической схемы производства аммиака высокотемпературную конверсию природного газа проводят в смеси с техническим кислородом или с воздухом, обогащенным кислородом.
На рис. 3 показана технологическая схема производства аммиака из природного газа.
Установка является головной в технологической схеме производства аммиака и правильное ведение режима в ней в конечном счете определяет требуемый состав азотоводородной смеси для синтеза аммиака. Соблюдение теплового режима способствует нормальной и стабильной работе системы парообразования.
В создаваемых в настоящее время технологических схемах производства аммиака мощностью свыше 1000 т МНз в суши с одного агрегата не предусмотрены отделения очистки конвертированного газа от окиси углерода медноаммиачными растворами или промывка жидким азотом.
На рис.
15 дана в упрощенном виде технологическая схема производства аммиака из природного газа. Как видно, схема является сложной.
Так, в настоящее время внедряются технологические схемы производства аммиака с мощностью одного агрегата 400 тнс. А в перспективный период будет освоено оборудование в производстве аммиака до 800 тнс.
Переход промышленности связанного азота на дешевый природный газ значительно-сокращает расходы по статье сырье. Кроме того, таким путем улучшаются условия труда на заводах, производящих синтетический аммиак. Это приводит также к упрощению технологической схемы производства аммиака.
Инструкция по применению
Нашатырь выпускается в нескольких формах:
- стеклянные флаконы от 10 до 100 мл для наружного применения;
- ампулы по 1 мл (10% водный раствора аммиака).
Хранят препарат в затемненных прохладных местах. Годность ампулы составляет 5 лет, флаконов — 2 года.
Показания к применению препарата
- Ингаляционно — для возбуждения дыхания, а также для быстрого выведения человека из обморочного состояния.
- Наружно — при обработке рук в хирургической практике и для обеззараживания кожи, чтобы устранить зуд после укусов различных насекомых.
- Внутрь — исключительно как рвотное средство.

Фармакодинамика препарата
При вдыхании нашатырного спирта препарат воздействует на рецепторы верхних путей дыхательной системы. При этом задействован рефлекторно-дыхательный центр. Также препарат рефлекторно оказывает воздействие на работу сердца и тонус сосудов.
Во время применения препарата внутрь возбуждается рвотный центр, за счет чего становится возможным опорожнение органов пищеварительной системы от токсинов.
При нанесении на кожу препарата, осуществляется отвлекающее действие через кожные рецепторы. Препарат подавляет очаг возбуждения, снижает боль и напряжение мышц, купирует спазмы тканей. На месте соприкосновения с препаратом разражаются рецепторы кожи, что и провоцирует высвобождение активных веществ. Благодаря этому происходит расширение сосудов, ускоряется процесс регенерации и питания тканей, нормализуется отток метаболитов.
Правила применения
В медицинской практике часто используется такой спирт для оказания раздражающего воздействие на рецепторы слизистой носа при обмороках, а также алкогольных отравлениях. Чтобы правильно использовать препарат, придерживайтесь следующей инструкции:
- Для нормализации дыхания и приведения человека “в чувства” при обмороке, к ноздрям пациента поднесите кусочек ваты, смоченной раствором аммиака.
- При алкогольном отравлении можно дать потерпевшему выпить нашатырь, но только в разведенном виде. Пропорции: на стакан воды — 5-6 капель.
- Как отхаркивающее средство используйте нашатырно-анисовые капли. Этот комбинированный препарат включает в себя раствор аммиака, этиловый спирт и анисовое масло. Рекомендуемая дневная доза:
- Для взрослых — до 15 капель (не более 5 капель дважды-трижды в сутки).
- Детям до 1 года — максимум по 1 капле, можно до 2 раз в день.
- Для провоцирования рвоты используйте препарат в разведенном виде: 5-7 капель препарата на полстакана воды.
- Для мытья рук в хирургической практике средство также применяйте в разведенном виде: 25 мл препарата на 5 л кипяченой теплой воды.
- Мазь, изготовленную из нашатырного спирта и ланолина в равных количествах, применяют для купирования неприятных симптомов после укусов насекомых.
Меры предосторожности
- Вдыхание паров раствора аммиака, нашатырного спирта в больших количествах может спровоцировать остановку дыхания и нарушение сердечного ритма.
- Если препарат в больших концентрациях принять внутрь, то появятся следующие симптомы: боль в животе, расстройство работы кишечника, рвота, судороги.
- Если передозировка произошла при ингаляции, то возможны насморк, кашель, оттек гортани, остановка дыхания.
- При наружном применении передозировка чревата ожогами.

Первая помощь при отравлении:
- При отравлении аммиаком пострадавшего необходимо вынести на свежий воздух, горло, нос, рот тщательно промыть водой. Для большей эффективности в воду добавьте глютаминовую или лимонную кислоту.
- При пропадании препарата на открытый участок тела, обильно промойте поврежденную кожу водой и накройте повязкой. Применять любые мази в течение 24 часов не рекомендуется, а в дальнейшем проведите терапевтическую обработку такую же, как и при термических ожогах.
- Если аммиак, нашатырный спирт высокой концентрации, попал в пищеварительный тракт, то хорошенько промойте желудок. Пострадавшему дайте выпить несколько белков от яиц, ложку растительного масла, стакан молока. Если есть возможность — сделайте клизму.
- При попадании брызг аммиака в глаза, немедленно промойте их проточной водой. После этого нанесите на пораженное место на коже вазелиновое или оливковое масло и закапайте глаза 0,5 % раствором дикаина, а при необходимости накройте глаза повязкой.
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:

- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей
При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.

Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Физические и химические свойства аммиака
Формула – NH3. Молярная масса – 17 г/моль.
Физические свойства аммиака
Аммиак (NH3
3
Связи между атомами в молекуле аммиака – ковалентные. Общий вид молекулы AB3. В гибридизацию вступают все валентные орбитали атома азота, следовательно, тип гибридизации молекулы аммиака – sp3. Аммиак имеет геометрическую структуру типа AB3E – тригональная пирамида (рис.
1).
Рис. 1. Строение молекулы аммиака.
Химические свойства аммиака
В химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами. Степень окисления азота в аммиаке «-3» —
минимальная, поэтому аммиак проявляет только восстановительные свойства.
При нагревании аммиака с галогенами, оксидами тяжелых металлов и кислородом образуется азот:
2NH3 + 3Br2 = N2 + 6HBr
2NH3
22
4NH3 +3O2 = 2N2 + 6H2O
В присутствии катализатора аммиак способен окисляться до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O (катализатор – платина)
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не проявляет кислотные свойства. Однако, атомы водорода в его молекуле все же способны замещаться на атомы металлов. При полном замещении водорода металлом происходит образование соединений, называемых нитридами, которые также можно получить и при непосредственном взаимодействии азота с металлом при высокой температуре.
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Раствор аммиака в воде имеет щелочную среду:
NH3 + H2O NH4OH NH4+ + OH—
При взаимодействии аммиака с кислотами образуются соли аммония, которые при нагревании разлагаются:
34
NH4Cl = NH3 + HCl (при нагревании)
Получение аммиака
Выделяют промышленные и лабораторные способы получения аммиака. В лаборатории аммиак получают действием щелочей на растворы солей аммония при нагревании:
Эта реакция является качественной на ионы аммония.
Применение аммиака
Производство аммиака – один из важнейших технологических процессов во всем мире. Ежегодно в мире производят около 100 млн. т. аммиака. Выпуск аммиака осуществляют в жидком виде или в виде 25%-го водного раствора – аммиачной воды. Основные направления использования аммиака – производство азотной кислоты
(производство азотсодержащих минеральных удобрений в последствии), солей аммония, мочевины, уротропина, синтетических волокон (нейлона и капрона). Аммиак применяют в качестве хладагента в промышленных холодильных установках, в качестве отбеливателя при очистке и крашении хлопка, шерсти и шелка.
Применение нашатырного спирта в быту
Аммиачная вода используется в садоводстве, а также в быту, как универсальное чистящее средство. Ее используют в борьбе с тлей, для обработки культурных посадок на участке от луковой мухи и для подкормки растений. Используют аммиак (нашатырный спирт) следующим образом:
Рецепт №1 — от тли:
- 4 ст. л. препарата разводят в 20 л воды. Количество можно менять, исходя из такой концентрации под нужный объем.
- Добавьте в раствор немного стирального порошка (для лучшего прилипания).
- Используйте раствор для опрыскивания растений при борьбе с тлей.
- Разводите 1-2 ст. л. нашатыря в ведре воды.
- Поливаете лук полученным средством — с момента посадки и до конца июня.

Рецепт №4 — чистка золота
- Смешайте 2 ч. л. нашатыря с 2 стаканами воды.
- Добавьте в раствор 1 ст. л. любого моющего средства.
- Поместите в чистящий раствор золотые украшения на 1-2 часа.
- После обработки, изделия промойте в воде и насухо протрите салфеткой.
Научные принципы химического производства
Они делятся на общие и частные принципы. Первые формулируют направления работы научной философии, вторые – концентрируются на решениях конкретных вызовов.
|
Общие принципы |
Частные принципы |
|
Создание оптимальных условий для химических реакций |
|
|
Комплексное полное использование сырья |
|
|
Использование теплоты химических реакций |
|
|
Принцип непрерывности |
|
|
Защита окружающей среды |
|
Как же эти принципы воплощаются? Чтобы дать ответ на этот вопрос, будут рассмотрены процессы создания химических веществ.
Химическое загрязнение окружающей среды и его последствия
Недостаток химического производства – загрязнение окружающей среды, вредоносное влияние на здоровье и жизнь человека и местной флоры с фауной. Негативные последствия накапливаются, приводя к ухудшению самочувствия. При размещении химического предприятия окружающая обстановка может кратно ухудшиться. Падает уровень жизни и удовлетворенность.
Чтобы не допустить этого, с химическим загрязнением окружающей среды борются. Это достигается с помощью следующих мер:
- Создание новых технологий и технических объектов, ориентированных на ресурсосбережение и малоотходность.
- Получение наибольшего объема продукции требуемого качества с наименьшими вложениями.
- Стремление к полному использованию исходного сырья.
- Поддержание экологической безопасности на предприятии.
Государство заинтересовано в поддержания благоприятной экологической обстановки. Для стимулирования уменьшения химического загрязнения окружающей среды и последствий используется налоговая экологическая политика, привязанная к объему выбросов и уровню опасности.
Рис 1. , Рис. 2 — Назарова, Т.С. Серия 7: Химическое производство. Металлургия: учеб. пособ.Т.С. Назарова, Н.С. Куприянова.
Смотри также:
- Понятие о металлургии: общие способы получения металлов
- Природные источники углеводородов, их переработка
- Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
- Применение изученных неорганических и органических веществ
Создание интегрированных производств и разработка новых технологий имеют особое значение
Как уже было сказано выше, технология постоянно совершенствуется и главным направлением мероприятий по ее улучшению является снижение энергоемкости самого процесса. А там, где это сделать по разным причинам сложно, применяются способы утилизации тепла, которое также способно принести пользу. Кроме того некоторые заводы по производству аммиака используют побочные продукты для других химических производств. Так может совмещаться, например, производство метанола и аммиака. Этот способ заключается в том, что из образующегося в ходе риформинга из угарного газа и воды синтезируется метанол.

Также было уже сказано про совмещенное производство аммиака и карбамида. Данное совмещение возможно, например, путем реакции полученного при риформинге углекислого газа с полученным аммиаком. Данный способ, конечно же, требует установки дополнительного оборудования. Тем не менее, он позволяет повысить полезную отдачу конкретного предприятия.
Еще одна особенность производства аммиака в промышленности состоит в том, что его цикличность также способствует и безотходности. Причем в ход идут как полученная энергия, так и побочные продукты. Даже сера, полученная при очистке исходного сырья, находит применение в других химических производствах. Помимо перечисленных мер происходит также постоянный поиск оптимального сочетания давления и температуры, при котором происходит процесс. Ведь от сочетания этих параметров зависит конечный выход основного продукта.
Учитывая все вышесказанное, можно с полной ответственностью сделать вывод,что современный завод по производству аммиака представляет из себя довольно сложный комплекс сооружений. Но в основе такого комплекса всегда состоит установка, разработанная в 1909 году немецким ученым Фрицем Габером, который помимо этого изобретения прославился тем, что стал «отцом химического оружия». По иронии судьбы этот ученый получил Нобелевскую премию Мира. Тем не менее, очевидно, что ценность его вклада в развитие современной химической промышленности сомнению не подлежит.
Таким образом, на примере промышленного производства аммиака можно увидеть, как годами можно совершенствовать, казалось бы, неизменный процесс
Также можно проследить, как одно изобретение может на многие года заложить развитие целой отрасли производства (причем, немаловажной) современного производства

В настоящее время заводы по производству аммиака расположены по всему миру. Более того: постоянно строятся новые предприятия
Данный факт еще раз подчеркивает важность этого вида химического производства. Ведь во многих регионах земного шара наличие, например, азотных удобрений, стало жизненной необходимостью
Можно привести и много других примеров, но факт остается фактом. Кроме того, огромная часть продукции газодобывающей промышленности востребована именно в производстве аммиака, что позволяет ей устойчиво развиваться. На этих немногочисленных примерах достаточно хорошо видно, что роль производства аммиака переоценить довольно трудно. Поэтому можно сделать вывод, что азотная промышленность будет существовать еще долго, а продукция ее будет всегда пользоваться устойчивым спросом.
Таким образом, говоря о производстве аммиака, следует понимать, что речь идет об очень серьезном производстве, которое оказывает огромное влияние на функционирование различных сфер, как хозяйственной деятельности, так и просто жизни людей
И вполне возможно, что важность данной отрасли в будущем будет расти

Применение и использование аммиака:
– в холодильной технике в качестве хладагента R717, где R – Refrigerant (хладагент), 7 – тип хладагента (неорганическое соединение), 17 – молекулярная масса,
– в медицине в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт,
– в химической промышленности для производства азотных удобрений (нитрат и сульфат аммония, мочевина),
– как сырье в химической промышленности для производства взрывчатых веществ, полимеров, азотной кислоты, соды (по аммиачному методу), нейлона, капрона и других продуктов химической промышленности,
– жидкий аммиак используют в качестве растворителя.
– в сельском хозяйстве в качестве удобрения в виде аммиачной воды.
Примечание: Фото https://www.pexels.com, https://pixabay.com,
Видео https://www.youtube.com/watch?v=SCTa_LD3Czw
Найти что-нибудь еще?
карта сайта
почему газообразный жидкий аммиак кислота формула связь можно водный химическая связь растворим растворили имеет является вычислите уравнение моль окисление концентрация свойства производство плотность образование синтез взаимодействие водный раствор получение запах масса какой объем молекула краска без аммиака для волос
Коэффициент востребованности
5 103
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Аммиак по физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Производство серной кислоты
В качестве серосодержащего сырья для производства серной кислоты могут быть использованы сера или сероводород (побочные продукты нефтепереработки), минерал пирит FeS2, а также сульфиды некоторых других d-элементов. Никакие другие виды сырья не используются.
В настоящий момент основным сырьем для производства серной кислоты являются сероводород и сера, поскольку они в огромных количествах образуются в качестве побочных продуктов нефтепереработки.
Однако же в школьной программе пока еще по-прежнему считается, что серная кислота производится преимущественно из пирита, в связи с чем и мы будем рассматривать основные стадии производства серной кислоты именно этого же сырья.
Первая стадия
Заключается в сжигании предварительно измельченного пирита в токе обогащенного кислородом воздуха. Процесс протекает в соответствии с уравнением:
Обжиг осуществляют при температуре около 800 оС в печи для обжига. В процессе обжига используют так называемый метод кипящего слоя – частицы измельченного пирита подаются в печь сверху, а воздух — снизу. В результате этого раскаленные частицы пирита оказываются подвешенными в токе воздуха, внешне напоминая кипящую жидкость.
После обжига пирита полученный печной газ, содержащий диоксид серы, отделяется от твердых примесей огарка (Fe2O3) с помощью циклона. Циклоном называют аппарат, в котором происходит грубая очистка печных газов за счет центробежной силы от наиболее крупных твердых частиц. Далее после грубой очистки смесь газов проходит более глубокую очистку уже от оставшихся мелких твердых частиц с помощью электрофильтра. Принцип действия электрофильтра основан на том, что к наэлектризованным металлическим пластинам прилипает пыль, которая после скопления ссыпается с них под собственным весом в приемник.
После очистки от твердых примесей печной газ направляется в нижнюю часть так называемой сушильной башни, в верхнюю часть которой впрыскивается концентрированная серная кислота на встречу газу. При таком варианте осуществления фактически сталкиваются два потока — смеси газов, идущей снизу, и струи жидкой концентрированной серной кислоты, текущей сверху. Очевидно, что в результате этого достигается максимальная степень «смешения» газа с осушающей жидкостью. Данный прием носит название принципа противотока.
Вторая стадия
После очистки от твердых примесей и осушки концентрированной серной кислотой газы поступают в контактный аппарат. В контактном аппарате расположены полки с катализатором V2O5, который катализирует взаимодействие диоксида серы с кислородом в соответствии с уравнением:
Аналогично реакции взаимодействия азота с водородом, рассмотренной выше, данная реакция также является каталитической, экзотермической и протекает с уменьшением количества газообразных веществ. Поэтому с точки зрения принципа Ле Шателье ее следовало бы проводить при низких температурах. Однако при низких температурах скорость реакции крайне низка, и ее осуществляют при оптимальной температуре около 400-500 оС. Смещения равновесия реакции в сторону разложения SO3 при повышении температуры удается практически полностью избежать, проводя реакцию при повышенном давлении.
Третья стадия (заключительная)
После второй стадии образовавшийся триоксид серы поступает в часть установки, называемую поглотительной башней.
Из названия данного аппарата логичным было бы предположить, что триоксид серы в нем поглощается в этой части установки водой, ведь триоксид серы, взаимодействуя с водой, образует серную кислоту. Однако в реальности серный ангидрид SO3поглощают не водой (!!!), а концентрированной серной кислотой. Связано это с тем, что при смешении серного ангидрида с водой выделяется колоссальное количество теплоты, в результате чего сильно возрастают температура, давление и образуются мельчайшие капли трудноуловимого сернокислотного тумана.
В результате поглощения SO3 концентрированной серной кислотой фактически образуется раствор SO3 в безводной серной кислоте, который называют олеумом. Далее образующийся олеум собирается в металлические емкости и отправляется на склад. Серную кислоту необходимой концентрации получают, добавляя к олеуму воду в нужной пропорции. В результате добавления воды избыток SO3 превращается в серную кислоту.
Внедрение технологий для получения аммиака
Получение NH3 в глобальных масштабах промышленного потребления началось с покупки патента технологий Ф. Габера представителем Баденского содового завода А. Митташем. В начале 1911 года синтез аммиака на небольшой установке стал регулярным. К. Бош создал большой контактный аппарат, исходя из разработок Ф. Габера. Это было оригинальное оборудование, обеспечивающее процесс извлечения аммиака путем синтеза в производственном масштабе. К. Бош взял на себя все руководство по данному вопросу.

Экономия энергозатрат предполагала участие в реакциях синтеза определенных катализаторов.
Группа ученых, работающая над поиском подходящих составляющих, предложила следующее: железный катализатор, в который добавлялись оксиды калия и алюминия и который поныне считается одним из наилучших, обеспечивающих получение аммиака в промышленности.
9.09.1913 начал свою работу первый в мире завод, применяющий технологию каталитического синтеза. Постепенно наращивались производственные мощности, и к концу 1917 года вырабатывалось 7 тыс. т аммиака за месяц. В первый год работы завода этот показатель составлял всего 300 т в месяц.
Впоследствии во всех других странах тоже стали применять технологию синтеза с применением катализаторов, которая по своей сути не очень отличалась от техники Габера — Боша. Применение высокого давления и циркуляционных процессов происходило в любом технологическом процессе.