Получение аммиака в промышленности и в лаборатории из азота
Содержание:
- Инструкция по применению
- Химическая технология. Производство аммиака и метанола
- Аммиак, формула, газ, характеристики:
- Получение аммиака в лабораторных и промышленных масштабах
- Раствор аммиака – получение и применение
- Технологическая схема — производство — аммиак
- История появления аммиака
- Особенности и этапы производственного процесса
Инструкция по применению
Нашатырь выпускается в нескольких формах:
- стеклянные флаконы от 10 до 100 мл для наружного применения;
- ампулы по 1 мл (10% водный раствора аммиака).
Хранят препарат в затемненных прохладных местах. Годность ампулы составляет 5 лет, флаконов — 2 года.
Показания к применению препарата
- Ингаляционно — для возбуждения дыхания, а также для быстрого выведения человека из обморочного состояния.
- Наружно — при обработке рук в хирургической практике и для обеззараживания кожи, чтобы устранить зуд после укусов различных насекомых.
- Внутрь — исключительно как рвотное средство.

Фармакодинамика препарата
При вдыхании нашатырного спирта препарат воздействует на рецепторы верхних путей дыхательной системы. При этом задействован рефлекторно-дыхательный центр. Также препарат рефлекторно оказывает воздействие на работу сердца и тонус сосудов.
Во время применения препарата внутрь возбуждается рвотный центр, за счет чего становится возможным опорожнение органов пищеварительной системы от токсинов.
При нанесении на кожу препарата, осуществляется отвлекающее действие через кожные рецепторы. Препарат подавляет очаг возбуждения, снижает боль и напряжение мышц, купирует спазмы тканей. На месте соприкосновения с препаратом разражаются рецепторы кожи, что и провоцирует высвобождение активных веществ. Благодаря этому происходит расширение сосудов, ускоряется процесс регенерации и питания тканей, нормализуется отток метаболитов.
Правила применения
В медицинской практике часто используется такой спирт для оказания раздражающего воздействие на рецепторы слизистой носа при обмороках, а также алкогольных отравлениях. Чтобы правильно использовать препарат, придерживайтесь следующей инструкции:
- Для нормализации дыхания и приведения человека “в чувства” при обмороке, к ноздрям пациента поднесите кусочек ваты, смоченной раствором аммиака.
- При алкогольном отравлении можно дать потерпевшему выпить нашатырь, но только в разведенном виде. Пропорции: на стакан воды — 5-6 капель.
- Как отхаркивающее средство используйте нашатырно-анисовые капли. Этот комбинированный препарат включает в себя раствор аммиака, этиловый спирт и анисовое масло. Рекомендуемая дневная доза:
- Для взрослых — до 15 капель (не более 5 капель дважды-трижды в сутки).
- Детям до 1 года — максимум по 1 капле, можно до 2 раз в день.
- Для провоцирования рвоты используйте препарат в разведенном виде: 5-7 капель препарата на полстакана воды.
- Для мытья рук в хирургической практике средство также применяйте в разведенном виде: 25 мл препарата на 5 л кипяченой теплой воды.
- Мазь, изготовленную из нашатырного спирта и ланолина в равных количествах, применяют для купирования неприятных симптомов после укусов насекомых.
Химическая технология. Производство аммиака и метанола
Ключевые слова конспекта: Химическая технология. Химические процессы, лежащие в основе производства аммиака и метанола. Характеристика этих процессов. Общие научные принципы химического производства. Биотехнология. Нанотехнология.
Химическая технология — это наука о наиболее эффективных методах и средствах переработки сырья (природных ресурсов) для получения веществ и материалов, используемых в различных отраслях хозяйства.
Область изучения химической технологии охватывает нефтехимию, целлюлозно-бумажную и пищевую промышленность, производство стройматериалов, чёрную и цветную металлургию и многие другие отрасли.
В курсе химии средней школы вы знакомились с важнейшими химическими производствами: чугуна и стали, алюминия, серной и азотной кислот, аммиака, полимеров, метанола и др. Обобщим представления о химическом производстве на примерах получения аммиака и метанола, которые имеют много общего.
Оба производства используют в качестве сырья природный газ метан. Из него путём конверсии (превращения) получают водород:
Необходимый для производства аммиака азот получают фракционной перегонкой жидкого воздуха.
В основе синтеза аммиака лежит химическая реакция, уравнение которой вы хорошо знаете: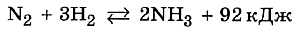
Нетрудно убедиться, что эта характеристика справедлива и для реакции синтеза метанола: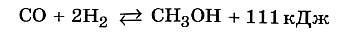
В производстве метанола используется цинк-хромовый катализатор ZnO / Cr2O3 • СгO3.
Такими условиями являются:
- увеличение концентрации исходных веществ и уменьшение концентрации продуктов, что достигается повышением давления (при этом аммиак и метанол превращаются в жидкость);
- понижение температуры, согласно принципу Ле Шателье, так как реакции экзотермические (при этом резко уменьшается скорость реакций, поэтому их проводят при оптимальных температурах: 450—500 °С для аммиака и 370—400 °С для метанола).
Рассмотрим схему установки по производству аммиака и метанола. Реагирующие смеси тщательно очищают и подают в турбокомпрессор, где аммиак сжимают до 25—60 МПа, а метанол до 25—30 МПа, смешивают с циркуляционным газом и направляют в колонну синтеза.
Колонны синтеза имеют разную конструкцию. Рассмотрим колонну, совмещающую в одном корпусе катализаторную коробку и теплообменник.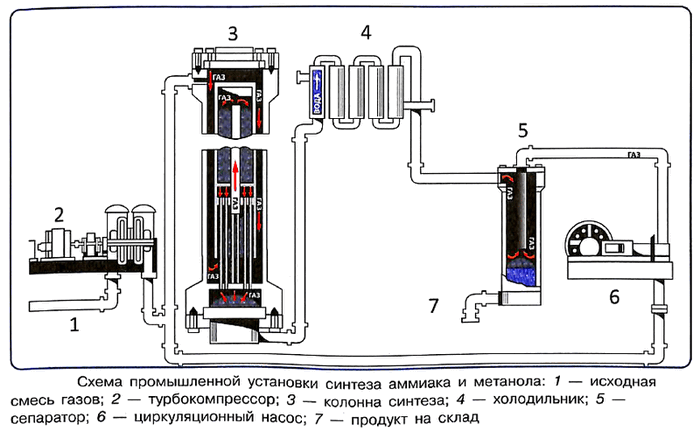
Исходную смесь газов сначала нагревают в теплообменнике за счёт движущихся противотоком выходящих газов. Противоток — движение веществ навстречу друг другу с целью создания наилучших условий для обмена энергией.
При всех указанных условиях проведения реакции равновесный выход продуктов составляет не более 20 %, поэтому синтез проводят по принципу многократной циркуляции, т. е. непрореагировавшую смесь газов много раз возвращают в производство после отделения полученных продуктов. Благодаря замкнутой схеме промышленный синтез аммиака и метанола полностью отвечает принципу экологической целесообразности и безопасности химического производства.
Современная технология сочетает достижения естественно-научных знаний физики, химии, биологии, экологии и др.
Инновационным направлением является биотехнология, т. е. использование живых организмов или клеточных структур для производства химических веществ.
В современной биотехнологии выделяют три направления: генная (или генетическая) инженерия, клеточная инженерия, биологическая инженерия.
В настоящее время бурно развивается новое направление химической технологии — нанотехнология. Её отличие от других технологических процессов состоит в производстве веществ и материалов с уникальными свойствами путём манипулирования атомами и молекулами. Это манипулирование осуществляется различными физико–химическими методами, например, порошковой технологией, физическим и химическим осаждением плёночных покрытий и др. Особую роль в нанотехнологии играют современные приборы, например сканирующие зондовые микроскопы.
XXI век обещает стать веком нанонауки и нанотехнологий. Лауреат Нобелевской премии по физике Ричард Фейнман ещё в 1959 г. утверждал, что проникновение в наномир — это бесконечный путь человечества, на котором оно практически не ограничено материалами, а следует лишь за собственным разумом.
Конспект урока по химии «Химическая технология». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Аммиак по физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Получение аммиака в лабораторных и промышленных масштабах
Аммиак (Nh4) представляет собой химическое соединение водорода с азотом. Свое название он получил от греческого слова «hals ammniakos» или латинского «sal ammoniacus» которые переводятся одиноково — «нашатырь». Именно такое вещество под названием аммония хлорид получали в Ливийской пустыне в оазисе Аммониум.
Аммиак считается очень ядовитым веществом, которое способно раздражать слизистые оболочки глаз и дыхательных путей. Первичными симптомами отравления аммиаком являются обильное слезотечение, одышка и воспаление легких. Но вместе с тем, аммиак – ценное химическое вещество, которое широко используется для получения неорганических кислот, например, азотной, синильной, а также мочевины и азотсодержащих солей. Жидкий аммиак — это превосходное рабочее вещество холодильных контейнеров и машин, так как он имеет большую удельную теплоту испарения. Водные растворы аммиака используют как жидкие удобрения, а также для аммонизации суперфосфатов и туковых смесей.
Получение аммиака из отходящих газов в процессе коксования угля является древнейшим и весьма доступным методом, но на сегодняшний день он уже устарел и практически не используется.
Современным и основным способом является получение аммиака в промышленности на основе процесса Габера. Его суть в прямом взаимодействии азота и водорода, которое протекает в результате конверсии углеводородных газов. В качестве исходного сырья выступают обычно природный газ, газы нефтепереработки, попутные нефтяные газы, остаточные газы от производства ацетилена. Суть метода конверсионного получения аммиака состоит в разложении метана и его гомологов при высокой температуре на составляющие: водород и окись углерода с участием окислителей – кислорода и водяного пара. При этом к конвертируемому газу подмешивают воздух, обогащенный кислородом, либо атмосферный воздух. Изначально реакция получения аммиака на основе конвертируемого газа протекает с выделение тепла, но с понижением объема исходных продуктов реакции:
N2 + 3h3 2Nh4 + 45,9 кДж
Однако получение аммиака в промышленных масштабах ведется с использованием катализатора и при искусственно созданных условиях, которые позволяют увеличить выход готового продукта. В атмосфере, где проходит получение аммиака, увеличивается давление до 350 атмосфер, а температура поднимается до 500 градусов Цельсия. При таких условиях выход аммиака — около 30%. Газ удаляется из зоны реакции с помощью метода охлаждения, а азот и водород, которые не прореагировали, возвращаются обратно в колонну синтеза и снова могут участвовать в реакциях
В ходе синтеза очень важно очистить смесь газов от каталитических ядов, веществ, способных сводить на нет действие катализаторов. Такими веществами являются пары воды, СО, As, P, Se, O2, S
В качестве катализатора в реакциях синтеза азота и водорода выступает пористое железо с примесями оксидов алюминия и калия. Только это вещество, из всех 20 тысяч ранее перепробованных, позволяет достичь равновесного состояния реакции. Такой принцип получения аммиака считается самым экономичным.
Получение аммиака в лаборатории основано на технологии вытеснения его из аммониевых солей сильными щелочами. Схематически эта реакция представлена следующим образом:
или
Чтобы удалить лишнюю влагу и осушить аммиак, его пропускают через смесь едкого натра и извести. Получение аммиака очень сухого достигается в результате растворения в нем металлического натра и последующей перегонки смеси. Чаще всего такие реакции проводят в закрытой металлической системе под вакуумом. Причем такая система должна выдержать высокое давление, которое достигается выделяющимися парами аммиака, до 10 атмосфер при комнатной температуре.
Раствор аммиака – получение и применение
Нитроген (азот) имеет несколько соединений с Гидрогеном (водород), из которых наиболее весомое значение имеет аммиак. В лабораторных условиях его получают при нагревании смеси хлорида аммония с гидроксидом калия. До конца 19 века чилийское месторождение натриевой селитры считали единственным источником соединений Нитрогена. Благодаря научным разработкам, химиками было предложено несколько методов фиксации атмосферного Нитрогена. Первым из них был цианамидный способ синтеза аммиака. Этот метод основан на свойстве азота соединяться с карбамидом кальция. Для этого пропускают азот через разогретый карбид кальция:
N2 + CaC2 = CaCN2 + С
Полученный таким образом CaCN2 (цианид кальция) используют в качестве нитратного удобрения в сельском хозяйстве. Следует сказать, что при обработке этого соединения водяным паром образуется аммиак:
CaCN2 + ЗН20 = 2Nh4+ СаС03
Аммиак перерабатывают на нитратную кислоту и азотные удобрения. В современной химии широко распространен другой метод получения Nh4 – синтез его из Нитрогена и Гидрогена:
1/2 N +3/2 h3 = Nh4
Полученный таким образом аммиак называют синтетическим. Промышленный синтез аммиака производят при наличии катализатора и при температуре 500 градусов.
Аммиак – газ, который имеет резкий характерный запах, он легче воздуха. Нельзя вдыхать Nh4 продолжительное время, поскольку он ядовит. Этот газ довольно хорошо растворяется в Н2О. Концентрированный водный раствор аммиака содержит 25 % Nh4.
При охлаждении (до -79°С) водный раствор аммиака переходит в кристаллогидрат. Научными исследованиями доказано, что основная масса Nh4 в водном растворе пребывает в виде гидратированных молекул (Nh4·nh3O) и лишь незначительная часть растворенного аммиака (около 0,5 %) взаимодействует с водой:
Nh4 + h3O = Nh5+ + ОН –
Щелочная реакция растворов аммиака обусловлена наличием гидроксид-ионов. Традиционно раствор аммиака обозначают как Nh5ОН. Щелочность раствора обуславливается наличием гидроксильной группы, которая образуется в результате диссоциации гидроксида аммония.
Раствор аммиака считают слабым основанием. В лабораториях иногда аммиак получают путем нагревания нашатыря. Аммиак довольно активное химическое соединение, взаимодействует со многими веществами, при этом проявляет только восстановительные свойства.
Аммиак горит, в присутствии Оксигена зеленовато-желтым пламенем, окисляясь при этом до свободного Нитрогена. При наличии катализатора (платины) окисление аммиака·идет дальше до образования оксида нитрогена. Эту реакцию используют в процессе получения нитратной кислоты. Следует сказать, что большая часть полученного таким образом аммиака расходуется на производство нитратных удобрений, а также нитратной кислоты.
В процессе испарения при -33,4 °С, жидкий Nh4 из окружающей среды поглощает очень много теплоты, вызывает охлаждение. Это свойство его используют в холодильных установках для получения искусственного льда при хранении скоропортящихся продуктов питания. Не редко жидкий аммиак используют при строительстве подземных конструкций. Раствор аммиака находит применение в лабораторной практике, химической промышленности, домашнем обиходе, и в медицине.
Раствор аммиака применение. Применяют как средство для возбуждения дыхания и выведения пациента из обморочного состояния. Большие концентрации Nh4 могут вызвать остановку дыхания. Иногда раствор аммиака используют как рвотное средство (10 капель на 100 мл воды). Следует учитывать, что это фармацевтическое средство нельзя применять наружно при наличии кожных заболеваний (экзема, дерматит). При отравлении парами аммиака медики назначают ацетатную, цитратную, тартратную (винную) кислоты в 1 % концентрации. В хирургической практике применяют раствор аммиака (25 мл/5 л кипяченой, теплой воды).
Технологическая схема — производство — аммиак
Технологические схемы производства аммиака включают от 5 до 9 основных технологических блоков, таких, как очистка исходного сырья, производство азотоводородной смеси, синтез аммиака и другие.
Если технологическая схема производства аммиака включает промывку газа жидким азотом, целесообразно проводить высокотемпературную конверсию природного газа под давлением до 30 am при температуре около 1350 С. В этом случае сухой конвертированный газ содержит примерно 96 % ( СО Н2) при остаточной концентрации метана около 1 % и низких расходных коэффициентах по природному газу и кислороду.
Если технологическая схема производства аммиака включает промывку газа жидким азотом, высокотемпературную конверсию природного газа целесообразно проводить под давлением до 3 0 МПа при температуре окрло-1350 С. В этом случае сухой конвертированный газ содержит примерно 95 5 % ( СО Н2) при остаточной концентрации метана около 1 % и низких расходных коэффициентах по природному газу и кислороду.
Если в технологической схеме производства аммиака не предусмотрена промывка жидким азотом, но имеется медноаммиачная очистка, для высокотемпературной конверсии природного газа целесообразно применять воздух, обогащенный кислородом. При этом остаточная концентрация метана в конвертированном газе не должна превышать примерно 0 5 %; достижение этого связано с повышением температуры реакции до 1400 С.
Если в технологической схеме производства аммиака не предусмотрена промывка газа жидким азотом, но имеются отделения низкотемпературной конверсии оксида углерода и метанирования, для высокотемпературной конверсии природного газа целесообразно применять воздух, обогащенный кис -: лородом. При этом остаточная концентрация метана в конвертированном газе не должна превышать примерно 0 5 %, что связано с повышением тем-1 пературы реакции до 1400 С.
В зависимости от технологической схемы производства аммиака масло, растворенное и диспергированное в сжатом газе, по-разному влияет на следующие стадии производства аммиака. Если на заводе имеется медно-аммяачная очистка под тем же давлением, что и синтез, газовый поток, содержащий масло, попадает в первую очередь в скрубберы медно-вшшшч-ной очистки, где оно загрязняет раствор, ухудтгает условия очистки газа и регенерации медно-аммиачного раствора, увеличивает расходные коэффициенты. Имеются данные, что очистка газа от масла только на стадии медно-аммиачной очистки дает.
В зависимости от технологической схемы производства аммиака высокотемпературную конверсию природного газа проводят в смеси с техническим кислородом или с воздухом, обогащенным кислородом.
На рис. 3 показана технологическая схема производства аммиака из природного газа.
Установка является головной в технологической схеме производства аммиака и правильное ведение режима в ней в конечном счете определяет требуемый состав азотоводородной смеси для синтеза аммиака. Соблюдение теплового режима способствует нормальной и стабильной работе системы парообразования.
В создаваемых в настоящее время технологических схемах производства аммиака мощностью свыше 1000 т МНз в суши с одного агрегата не предусмотрены отделения очистки конвертированного газа от окиси углерода медноаммиачными растворами или промывка жидким азотом.
На рис.
15 дана в упрощенном виде технологическая схема производства аммиака из природного газа. Как видно, схема является сложной.
Так, в настоящее время внедряются технологические схемы производства аммиака с мощностью одного агрегата 400 тнс. А в перспективный период будет освоено оборудование в производстве аммиака до 800 тнс.
Переход промышленности связанного азота на дешевый природный газ значительно-сокращает расходы по статье сырье. Кроме того, таким путем улучшаются условия труда на заводах, производящих синтетический аммиак. Это приводит также к упрощению технологической схемы производства аммиака.
История появления аммиака
Впервые аммиак получил в 1774 году английский химик Джозефом Пристли. Открытый им газ получил название “щелочного воздуха”, так как химический состав химик, а одновременно и священник, определить не смог. Лишь спустя 11 лет (в 1785 году) Клод Луи Бертолле — известный французский химик определил химический состав газа и назвал его аммиаком (NH3).
На счет того, почему газ назвали именно так, имеется две версии:
- одну связывают с именем бога древних египтян — Амоном;
- вторую — со сходным по звучанию оазиса в районе северной Африки — “Аммона”.
По первой версии, люди, поклоняющиеся богу Амону, во время обряда нюхали нашатырный спирт.
Согласно второй — в оазисе Аммона, который находится на перекрестке караванных путей, из-за нахождения огромного количества вьючных животных, скапливались продукты их жизнедеятельности. При условиях жаркого климата мочевина имеет свойство быстро разлагаться и выделять газ, названный аммиаком.
Какая из двух версий достоверная и правильная — неизвестно и по сей день.
Особенности и этапы производственного процесса
Процесс производства аммиака характеризуется большой энергоемкостью, что является главным его недостатком. Именно поэтому постоянно ведутся научные разработки, которые призваны решить проблемы экономии энергии. В частности разрабатываются способы утилизации выделенной энергии, а также совмещение, например, производства аммиака и карбамида. Все это способствует удешевлению деятельности предприятий и повышению их полезной отдачи.
В основу производства аммиака положены принцип циркуляции, согласно которому процесс идет непрерывно, причем остатки исходных компонентов отделяются от конечного продукта и используются вновь, непрерывности: процесс синтеза происходит без остановки, принцип теплообмена, а также принцип цикличности. Как видно, все эти принципы между собой тесно взаимосвязаны.

Сама технологическая схема производства аммиака зависит, прежде всего, от сырья, из которого получается конечный продукт. Дело в том, что, в отличие от азота, который содержится в воздухе в больших количествах, водород в чистом виде в природе практически не присутствует, а выделять его из воды — довольно трудоемкий и энергозатратный процесс.
Поэтому в качестве сырья для производства аммиака в основном используются углеводороды, содержащиеся в природном газе. В настоящее время именно природный газ является одной из основ аммиачной промышленности. Прежде чем попасть в колонну синтеза, газ проходит несколько стадий обработки. Начинается процесс с того что производится очистка исходного сырья от серы при помощи десульфуратора.
Далее идет так называемый процесс риформинга, который заключается в том, что в его ходе углеводороды сначала превращаются в метан, потом происходит довольно сложный процесс превращения метана в смесь водяного пара, угарного газа, углекислого газа и водорода. При этом также происходит очистка смеси от углекислого газа, после чего водород попадает в колонну синтеза под большим давлением вместе с азотом. Таким образом, прежде чем начать непосредственно производство аммиака, технология предполагает предварительную обработку сырья.

Все процессы риформинга, как и непосредственно сам синтез конечного продукта, происходят при высоком давлении и большой температуре. Именно это приводит к большой их энергозатратности. При этом указанные параметры на всех стадиях производства изменяются.
Сама колонна обычно изготавливается из стали. В ней размещен катализатор, состав которого может быть разным. После прохождения цикла синтеза смесь попадает в холодильник, где от нее оделяется аммиак в жидком виде, а оставшиеся после реакции компоненты снова идут в производство. Такая особенность технологического процесса вызвана тем, что реакция синтеза аммиака является обратимой и в ходе технологического процесса часть конечного продукта распадается на исходные компоненты.
Таким образом, производство аммиака в промышленности, несмотря на кажущуюся простоту реакции, которая лежит в основе процесса, на самом деле является довольно сложной технологической задачей.